1 前言
藥品生產企業是關系到我國國計民生的重要產業群體。GMP作為國際性德《藥品生產質量管理規范》,是國內藥品生產企業的指導原則和能否進入國際市場的基本條件。GMP認為任何藥品質量的形成是生產而不是檢驗出來的,因此必須強調預防為主,在生產過程中建立質量體系,實現全面質量管理,確保藥品質量。ERP、SCM等位代表的信息化系統普遍針對的是企業的上層運營管理,很難深入到生產的現場,難以從生產執行的細節中獲取非常詳細的信息,來消除產生問題的根源。
文章涉及的基于GMP的MES軟件系統,將面向藥品生產業務管理層和藥品生產車間作業執行層,充分滿足制藥企業以質量管理為核心的生產業務綜合管理需求。系統有機將GMP融入到生產制造執行系統(MES)和整個生產管理過程之中,從企業原材料采購、生產計劃、質量檢驗到庫存管理、成本管理、設備管理等業務管理層面,在充分滿足制藥企業GMP規范化管理的基礎上,實現對設備工況、物料狀態、計劃執行的實時跟蹤、回溯以及車間管控流程的可視化管理。
文章在介紹了GMP標準的同時,重點研究了藥品生產業務流程設計建模、藥品質量閉環管理機制和模型設計、生產過程質量溯源方法設計,以及基于這些分析和設計的MES系統功能和架構。
2 GMP管理規范間接
GMP(Good Manufacturing Practice)在國內名為“藥品生產質量管理規范”,是國內所有制造企業必須遵循的規范,其核心內容是全面質量管理。GMP是一套設計用于每一批產品使用的秩序和良好操作規范,所有能為患者提供一致和質量可靠的產品。
任何批次藥物的適應性由如下因素決定:起始物料的質量、廠房與設備的質量、程序的合適、沒有加工問題、過程中控制的質量、生產者的培訓和態度,GMP就是為了尋求這些主要問題在所有時間內有合適控制的保證。
GMP強調的幾個方面如下:
(1)物流控制及可追溯性。要求對存儲有效期內物資的存放、搬運和保管進行可追溯性控制。
(2)設備的控制和保養。要求對設備的標準、確認、驗證和保養進行控制。
(3)關鍵工序的控制。對該工序設備的準確度、緊密度、操作人員的資格、技能、知識,以及操作環境等進行控制。
(4)文件控制。對文件的標識、保管、使用和變更要進行控制。
(5)工藝更改控制。工藝更改必須滿足規定的質量要求,要制定工藝負責人修改和相關部門負責人會簽。
(6)驗證狀態的控制。要求對設備、設施、工藝等驗證狀態進行標識。
(7)不合格品的控制。要求建立不合格品的評定、處理和統計程序。
3 藥品生產業務流程建模分析
只要業一般分為原料藥生產和藥物制劑生產,原料藥是藥品生產的物質基礎,但必須加工制成合適與服用的藥物制劑才成為藥品。制藥行業作為流程工業的一種,有流程工業所具有的共性。都是通過各種生物、化學、物理變化。產生新物質而達到增值目的。
藥品生產又有其特殊性,其生產是一個非常復雜的過程,通常以批量或連續的方式進行生產,需要嚴格的過程控制和安全措施。這些特殊性包括:藥品的工藝機理復雜,同樣的操作條件也很難得到相同結果;制藥企業主要是大批量生產和面向庫存生產,沒有作業單的概念;制藥行業中體現了以配方為核心的生產模式,以流水線方式組織生產。只存在連續的工藝流程,不存在與離散企業對應的嚴格的工藝路線;藥品生產過程要求有十分嚴格的批號記錄,從原材料、供應商、中間品以及銷售給用戶的產品,都需要記錄,這些批次信息將用來進行生產回溯和問題跟蹤,藥品批次信息流程圖如圖1所示。
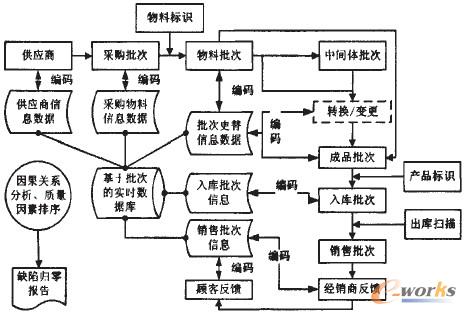
圖1 藥品物料批次信息流程圖
如上所述,藥品的生產過程要滿足GMP、FDA等法規的要求,實現規范操作。則從生產計劃、質量管理再到產品銷售和回收都要以GMP規范和質量管理為核心,設計藥品生產運作管理業務流程如圖2所示。
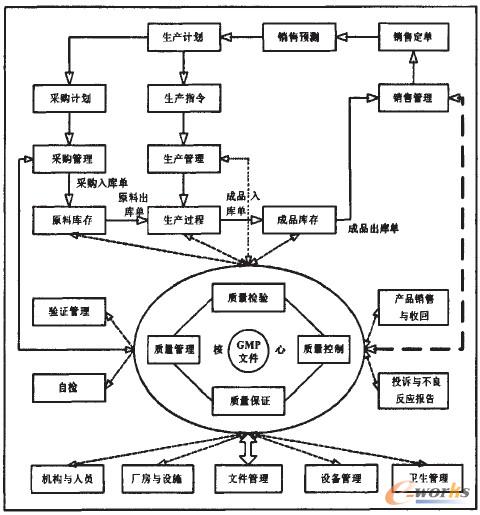
圖2 藥企生產運作流程圖
4 藥品生產流程標準機制設計
制藥企業生產流程包括:供應商質量控制、原輔料檢驗、原輔料倉庫和配送管理、車間配置生產、成品檢驗和成品包裝管理。在對生產流程進行分析之后,需要結合制藥企業面向質量和規范操作的生產運作管理特點。通過對藥品生產過程中涉及的檢驗、驗證、質量跟蹤、質量過程控制、標準化及質量反饋和質量改進等主要質量管理過程的深入研究,采用多維事件驅動過程網絡模型描述和構建藥品生產運作管理過程模型,將藥品生產過程管理與質量過程控制緊密結合,通過對質量信息流的控制實現對藥品質量保證的方法及相關技術措施,在信息集成的基礎上。實現藥品生產過程與質量控制過程的過程集成和閉環管控。其主要原理設計如圖3所示。
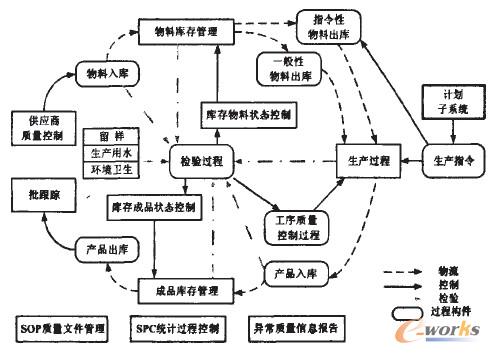
圖3 藥品生產面向質量的閉環管控模型圖
閉環管控模型從物流、生產控制流兩條主線出發。圍繞檢驗過程進行整個生產質量控制。
閉環實時信息的傳遞和反饋主要采用基于條碼及RFID的身份識別技術實現藥品生產全生命周期的信息追蹤。
5 藥品批生產過程質量溯源方法設計
藥品生產是以成品批來組織生產的。一個成品批次生產指令的下達驅動一個藥品生產物流過程及一個批次藥品的形成。GMP中定義“批”是指:在規定限度內具有同一性質和質量。并在同一生產周期中生產出來的一定數量的藥品為一批,主要有物料批和成品批。
藥品生產物流過程是一個成品批次的整個形成過程,它始于生產指令的下達,止于成品的入庫,通常采用“批號”來標識同一批的產品。系統將采用條碼來標識記錄藥品生產物流各階段“批號”信息。主要有以下幾種情況生成批次:
(1)采購到貨,采購原材料到貨時要確定原材料的批號;
(2)生產領料,生產部門在生產領用時在領料單上注明原材料的入庫批次;
(3)庫存調整,在庫存盤點或者調整時,有些數量較少的品種原材料的不同批次可能會被合并;
(4)產品生產,生產部門按照批生產指令組織生產,產品的批次按照批生產指令進行標識;
(5)產品銷售,銷售產品時會生成銷售批次。
生成批次以后,為在批次間進行追蹤或質量追溯,需要建立新舊批次的關聯關系,即批次關聯。關聯關系表具有雙向性。可以正向或者反向進行查詢。
通過批次關聯將不同的批次聯系起來。就可以建立起覆蓋供應鏈上藥品物流信息業務流程的批次管理模型,如圖4所示。模型將制藥企業的采購、庫存、生產、銷售流程通過批次貫通為一體,打破了原有的各部分信息的界限,建立完善的對應記錄。與最終產品的批次號相關聯,為產品追蹤和質量追溯技術的實現打下了基礎。
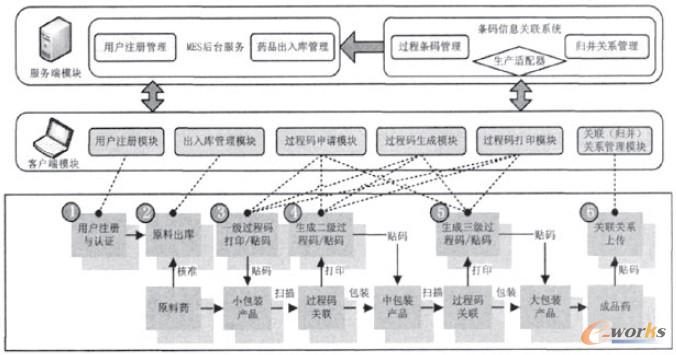
圖4 基于批次的藥品物流信息生成流程圖
6 基于GMP的MES系統功能及架構
在生產管控流程和質量溯源方法分析設計之后,設計的基于GMP與制藥企業MES系統將包括GMP管理子系統和制藥企業生產執行子系統。如圖5所示。
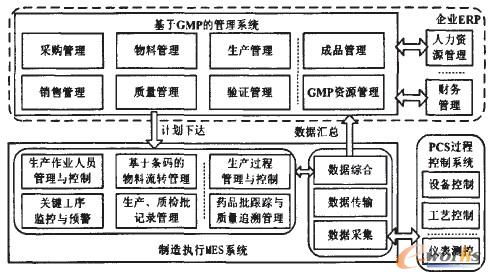
圖5 藥企MES系統整體功能架構圖
GMP管理子系統完成包括采購、物料、質量等方面的功能,包括:
(1)采購管理,包括采購計劃管理、采購訂單管理、采購批次管理、采購到貨管理、退貨管理、供應商管理等功能;
(2)物料管理,包括倉儲庫位管理、物料管理、入庫驗收管理、批號管理、庫存控制等功能;
(3)生產管理,包括生產計劃管理、生產指令管理、生產物料管理等功能;
(4)成品管理,包括成品入庫管理、成品出庫管理、其它成品庫存管理等功能;
(5)銷售管理,包括客戶檔案管理、銷售業務管理、銷售業務跟蹤管理、銷售統計管理、銷售分析管理等功能;
(6)質量管理,包括質量檢驗管理、質量保證管理、質量統計與分析等;
(7)驗證管理,包括驗證對象及標準管理、驗證對象及其驗證標準管理、驗證類型管理、項目驗證過程管理、驗證文件管理等功能;
(8)GMP資源管理,包括機構與人員管理、廠房與設施管理、GMP文件管理、設備管理及衛生管理等子模塊。
制藥企業生產執行系統(MES)則完成與GMP管理系統下達的計劃,并完成執行反饋,主要功能包括:
(1)基于條碼的物料流轉管理,包括:原料入庫收貨、原料檢驗QA、材料區數據采集、包裝區數據采集等功能;
(2)車間作業人員管理與控制。實現車間班組人員的人員資歷、出勤、作業考核、工作績效、培訓資質的管理等;
(3)生產作業過程管理與控制。包括車間作業任務、車間工藝能力等功能;
(4)生產、質檢批記錄管理,采集各環節生產、質量數據及原材料批次、生產員工、設備等相關數據,實現生產現場各類批記錄信息的電子化管理;
(5)藥品批跟蹤與質量追溯管理,建立各個藥品批次的工藝數據檔案和生產譜系檔案,實現藥品批跟蹤與質量追溯管理;
(6)關鍵工序監控與預警,在制藥企業關鍵工序識別的基礎上,通過關鍵工序質控點、監控項目、監控標準的自定義功能,建立關鍵工序質控點監控管理體系。
7 結語
通過詳細分析了制藥行業大批次生產管理的特點,提出了以GMP為質量管理核心的制造執行系統(MES)的功能和體系結構。闡述了企業信息集成及生產過程優化方法,解決了生產信息與上層管理信息的集成問題。以本設計為基礎開發的MES系統軟件已在在大型制藥企業推廣使用。同時,成果還有望推廣到食品、化工等眾多以配方批量生產為特點的制造業企業。
轉載請注明出處:拓步ERP資訊網http://www.hanmeixuan.com/
本文網址:http://www.hanmeixuan.com/html/consultation/1081997678.html